Wat gebeurt er als er water kookt
![close-up-of-a-person-boiling-rigatoni-pasta-in-the-saucepan-over-the-electric-stove_23-2147893448[1]](https://natuurwetenschappen.nl/wp-content/uploads/2004/08/close-up-of-a-person-boiling-rigatoni-pasta-in-the-saucepan-over-the-electric-stove_23-21478934481.jpg)
<a href='https://www.freepik.com/free-photo/close-up-of-a-person-boiling-rigatoni-pasta-in-the-saucepan-over-the-electric-stove_3052677.htm'>Designed by Freepik</a>
Uiteraard ben ik naar school geweest. Ik heb 2 vrienden die zelfs nu nog dagelijks naar school gaan; het zijn leraren. Je weet wel, die types die alles altijd beter weten. De discussie ging laatst over 2 zaken. Zij beweren dat er lucht vrijkomt bij het koken van water en dat er zich zelfs een scheikundiug proces afspeelde tijdens het koken van water nl. het afsplitsen van de H atomen van de O atomen (zo zou de lucht “O”ontstaan). Kunnen jullie met een waterdicht antwoord (met bronvermelding anders geloven ze het nog niet) uiteenzetten hoe het wel zit.
Als je koud water kookt zie je dat er “luchtbelletjes” op de wanden onstaan bij het opwarmen. Veel stoffen lossen namelijk op in water. In tegenstelling tot zouten en b.v. suiker wat steeds beter oplost in water bij het verhogen van de temperatuur lossen gassen steeds slechter op bij het verhogen van de temperatuur.
De oplosbaarheid van gassen geeft men aan in mol/liter of mg/liter. In onderstaande figuur staan de oplosbaarheden van zuurstof O2 en CO2
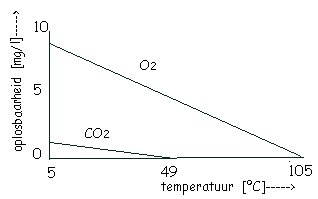
Je ziet dat met het toenemen van de temperatuur de oplosbaarheid afneemt. De zuurstof [O2] en kooldioxide [CO2] komen dus als luchtbelletjes vrij bij het verwarmen. Het water splitst zich niet in H2 en O2, hiervoor heb je electrolyse nodig of zeer hoge temperaturen.
In de proces industrie zijn zuurstof en kooldioxide in water ongewenst i..v.m. corrosie. Het water wordt dan ook eerst ontgast in vacuum torens en desgewenst verwarmd in ontgassers om voornamelijk O2 en CO2 te verwijderen. Behalve zuurstof en kooldioxide lossen ook andere gassen op in water. In onderstaande tabel zijn de oplosbaarheden aangegeven in mol/dm³
| temp | HCl zoutzuur | O2 10^-4 | N2 10^-4 | H2S 10^-2 | SO2 | CO2 10^-2 | CO 10^-4 | Cl2 10^-2 | |
| 0 C | 22,6 | 21,8 | 10,5 | 20,8 | 3.56 | 7,63 | 15,8 | 20,6 | |
| 20 C | 19,7 | 13,8 | 6,88 | 11,5 | 1,76 | 3,88 | 10,4 | 10,3 | |
| 50 C | 16,2 | 9,33 | 4,87 | 6,21 | 0 | 1,92 | 7,19 | 5,54 | |
| 100 C | 0 | 7,59 | 4,24 | 3,62 | 0 | 0 | 6,29 | 0 |
bij atmosferische druk. Bij hogere drukken lossen gassen beter op en bij lagere drukken slechter, vandaar dat men vacuum torens voor ontgassing van water gebruikt. Dit effect is eigenlijk hetzelfde als bij een flesje frisdrank wat je openmaakt. Bij een lagere druk (bij het openmaken) kan er minder CO2 in oplossing blijven en komen de CO2 belletjes vrij. Bij het oplossen van CO2 in water onstaat trouwens het (onstabiele) koolzuur H2CO3 d.w.z. dat het weer gemakkelijk ontleed volgens de formule H2CO3 <–> H2O + CO2.
Bij het koken van water komen dus de in het water opgeloste gassen weer vrij en verder veranderd er aan de structuur van het water niets.
Als het water eenmaal kookt, wordt het water omgezet in waterdampbellen. In het begin berijken deze nog niet de oppervlakte en imploderen ze weer. Dit geeft in sommige gevallen een knallend geluid als [grote] bellen weer imploderen. Berijken ze eenmaal de oppervlakte dan onstaat gasvormig water ofwel stoom.
***arjen***




