de chemische reakties van een accu
ik ben op zoek naar de chemische reactie die in accus plaatsvinden, ik kan het nergens vinden.
Beste boer, mijn collega martin heeft al eens een artikel geschreven over accu’s =-= zie Hoe werkt een accu.
En inderdaad, de chemische reactievergelijkingen voor laden en ontladen ontbreken en zijn ook niet (makkelijk) op internet te vinden. Het zijn zogenaamde redox reacties, d.w.z. chemische reacties waarbij elektronenoverdracht plaatsvind. De reactie in een loodaccu tussen het zwavelzuur en de loodplaten kan dus alleen als er ook elektronen gaan stromen, en dat is precies wat we willen gebruiken (de elektronenstroom) Als we geen stroom uit de accu of batterij gebruiken vinden er dus ook geen reacties plaats en blijft de accu in principe vol.
Lees verder ……
Zijn de chemische reacties tijdens laden en ontladen precies elkaars tegengestelde, dan is het element na ??n keer laden en ontladen weer in de toestand als voor het proces. Het laden en ontladen kan dus steeds herhaald worden. Men spreekt dan van een accumulator (Lat.: accumulare = verzamelen). Tijdens het laden wordt elektrische energie omgezet in chemische energie, tijdens het ontladen gebeurt het omgekeerde. De accu verzamelt dus energie.
De bekendste accu is de loodaccu. Deze bestaat uit een zwavelzuuroplossing met daarin, v??r het laden, twee loodplaten, die beide bedekt zijn met een laagje van het onoplosbare loodsulfaat (PbSO4) . De accu is dan symmetrisch (PbSO4– H2SO4 – PbSO4).
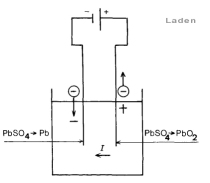
Sluiten we de elektroden aan op een gelijkspanning, dan zal het loodsulfaat aan de anode elektronen leveren volgens :
PbS04 + 2 H2O -> PbO2 + 4 H+ SO4— + 2 e [ e = elektronen ]
Het loodsulfaat aan de kathode neemt echter elektronen op:
PbSO4 + 2 e -> Pb + S04—
Zowel lood als lood(IV)oxide (PbO2) zijn oplosbaar. Het laagje loodsulfaat op de anode wordt dus omgezet in het bruine lood(IV)oxide, terwijl aan de kathode uit het loodsulfaat lood gevormd wordt. De situatie wordt asymmetrisch (Pb-H2SO4-PbO2): er ontstaat een polarisatie-element [1]. Als al het loodsulfaat is omgezet wordt het laden gestaakt. De accu kan nu gebruikt worden als stroombron. De E.M.K. van polarisatie is tegengesteld aan de laadspanning dus de stroom loopt nu in omgekeerde richting: de PbO2-pool wordt de positieve pool, de Pb-pool de negatieve.
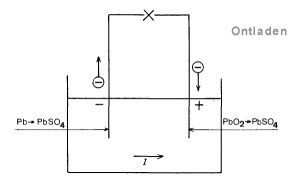
Tijdens het ontladen neemt het loodperoxyde (PbO2)elektronen op van de positieve plaat:
PbO2 + 4 H+ + SO4— + 2 e –> PbSO4 + 2 H2O
Het lood staat aan de negatieve plaat elektronen af: Pb + S04— –> PbS04 + 2e
Hieruit blijkt, dat aan de eis is voldaan, dat de reacties tijdens laden en ontladen eikaars tegengestelde zijn. De accu kan na het ontladen dus opnieuw geladen worden. Zie onderstaande schema’s
[1] Een polarisatie element wil zeggen dat er een tegen EMK onstaat. Het gebeurt o.a. bij het element van Volta, waarbij aan de anode waterstof onstaat wat een 2e EMK geeft die het element tegenwerkt. Dat is ook de reden dat het element van Volta niet gebruikt wordt.
Voor gewone zink kool batterijen (ook wel droge batterij genoemd) heeft men dit opgelost door een oxidatiemiddel bij de batterij in te doen die de waterstof omzet in water. Een gewone droge batterij (die je dus in de winkel koopt) noemt men ook wel een Leclanche element (naar de bedenker van deze batterij). Een gewone batterij heeft als anode (+) een koolstofstaafje, wat omgeven is door bruinsteen (MnO2) wat als oxidator fungeert. De kathode (-) is van zink, en als elektrolyt gebruikt men amoniumcloride (NH4Cl). [Dit is overigens dezelfde stof, die ook de zoute smaak aan drop geeft, maar dit terzijde].
***arjen***




