Brandstofcel
Hallo,
Wij zijn drie jongens die voor ons profielwerkstuk een brandstofcel willen gaan maken. Wij wilden vragen of dit mogelijk is, en als dat mogelijk is, wat zijn hiervoor dan de beste methodes.
Bij voorbaat dank
Matthijs, Arnoud en Ali
Zo, jullie leggen de lat een beetje hoger en dat kan ik wel waarderen. Een professionele brandstofcel is wellicht een stapje te ver, want daar gebruikt men allerlei exotische materialen voor die niet bij de Gamma in het rek liggen. Het principe van een brandstofcel is echter redelijk simpel en als je genoegen neemt met een bedroevend laag rendement is hij zelfs ook nog te maken. Uiteindelijk gaat het om het principe neem ik aan en dat maakt het dan ook leuk, dus aan het werk……
Lees verder ……….
In tegenstelling tot een accu, waarbij het lood en lood(IV)oxide (tijdelijk) verbruikt wordt, kan men ook “tijdens bedrijf” de werkzame stoffen toevoeren. Dit gebeurt in een brandstofcel.
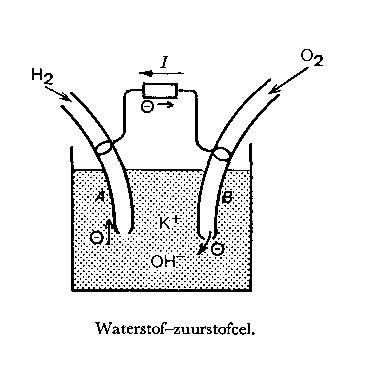
De eenvoudigste brandstofcel is de waterstof-zuurtofcel. In een oplossing van kaliumhydroxide (K+ + OH–) staan 2 holle elektroden. Door A op de tekening wordt waterstof aangevoerd en door B de zuurstof. Bij A verbinden de OH– -ionen zich met de waterstof onder de afgifte van elekronen: 4 OH– + 2 H2 ? 4 H2O + 4 e(lektronen)
Bij B worden juist elektronen van de elektrode opgenomen volgens: 02 + 2 H2O + 4e ? 4 OH–
A wordt dus negatief geladen, B positief. Wordt het element gesloten, dan gaat er door de draad een stroom van B naar A. [merk op dat de richting van de elektronen stroom tegengesteld is aan de stroonrichting (I)]
Door optellen van de beide reactievergelijkingen vind je als resulterende vergelijking:
2 H2 + O2 ? 2 H2O + elektrische energie.
Steekt men een mengsel van waterstof en zuurstof aan, dan verloopt dezelfde reactie, maar dan met een grote warmte-ontwikkeling, die eventueel met behulp van een turbine en een dynamo omgezet kan worden in elektrische energie. In de brandstofcel vindt de omzetting van chemische in elektrische energie direct plaats. In tegenstelling tot de accu is de brandstofcel dus in principe gelijk aan een chemisch element (Volta zuil). Het enige verschil is, dat de om te zetten stoffen hier continu toe-gevoerd worden.
Van energiebronnen kun je de volgende indeling maken:
1 omzetting van warmte (thermische energie) in elektrische energie: thermo-element;
2 omzetting van chemische in elektrische energie:
a chemisch element;
b brandstofcel;
3 omzetting van elektrische energie via chemische energie in elektrische energie: accu.
4 omzetting van mechanische in elektrische energie: dynamo.
Laat nog es weten hoe het afgelopen is en wat voor spanning/stroom/vermogen de cel heeft opgeleverd.
***arjen***
N.B. Waterstof, vooral in combinatie met zuurstof is redelijk explosief. Neem dus de nodige voorzorgsmaatregelen als je gaat experimenteren met deze cel !!!!!!

![ice-cubes-water_1284-6392[1]](https://natuurwetenschappen.nl/wp-content/uploads/2019/02/ice-cubes-water_1284-63921-300x233.jpg)
![geothermal-wells_431-19315590[1]](https://natuurwetenschappen.nl/wp-content/uploads/2018/09/geothermal-wells_431-193155901-300x198.jpg)




